Op deze pagina worden de diverse radioactieve stoffen aangeduid met atoomnotatie. Hieronder een korte uitleg over atomen en atoomnotatie.
Atomen zijn in de natuur in normale omstandigheden de kleinste ondeelbare deeltjes. Natuurkundigen hebben echter uitgevonden dat ze in realiteit weer onder te verdelen zijn in nog kleinere deeltjes, namelijk:
- neutronen
- protonen
- electronen
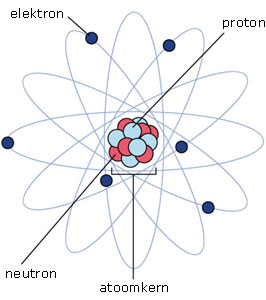
model van het atoom
De protonen en neutronen vormen de atoomkern en bezitten de meeste massa. De electronen draaien op grote afstand om de atoomkern heen en hebben praktisch geen massa.
In een atoom hebben protonen een positieve lading, en electronen een negatieve lading. Deze ladingen zijn bij een normaal atoom exact met elkaar in balans.
Voor de eigenschappen van een atoom zijn er twee belangrijke nummers:
- atoomnummer, welke aangeeft hoeveel protonen in de kern zitten
- massagetal, welke het aantal neutronen en protonen bij elkaar is
Een volledige notatie van een atoom zet het massagetal boven en het atoomnummer onder, gevolgd door de naam van het element. Hieronder is te zien hoe dat er uit ziet voor de 3 isotopen van waterstof:
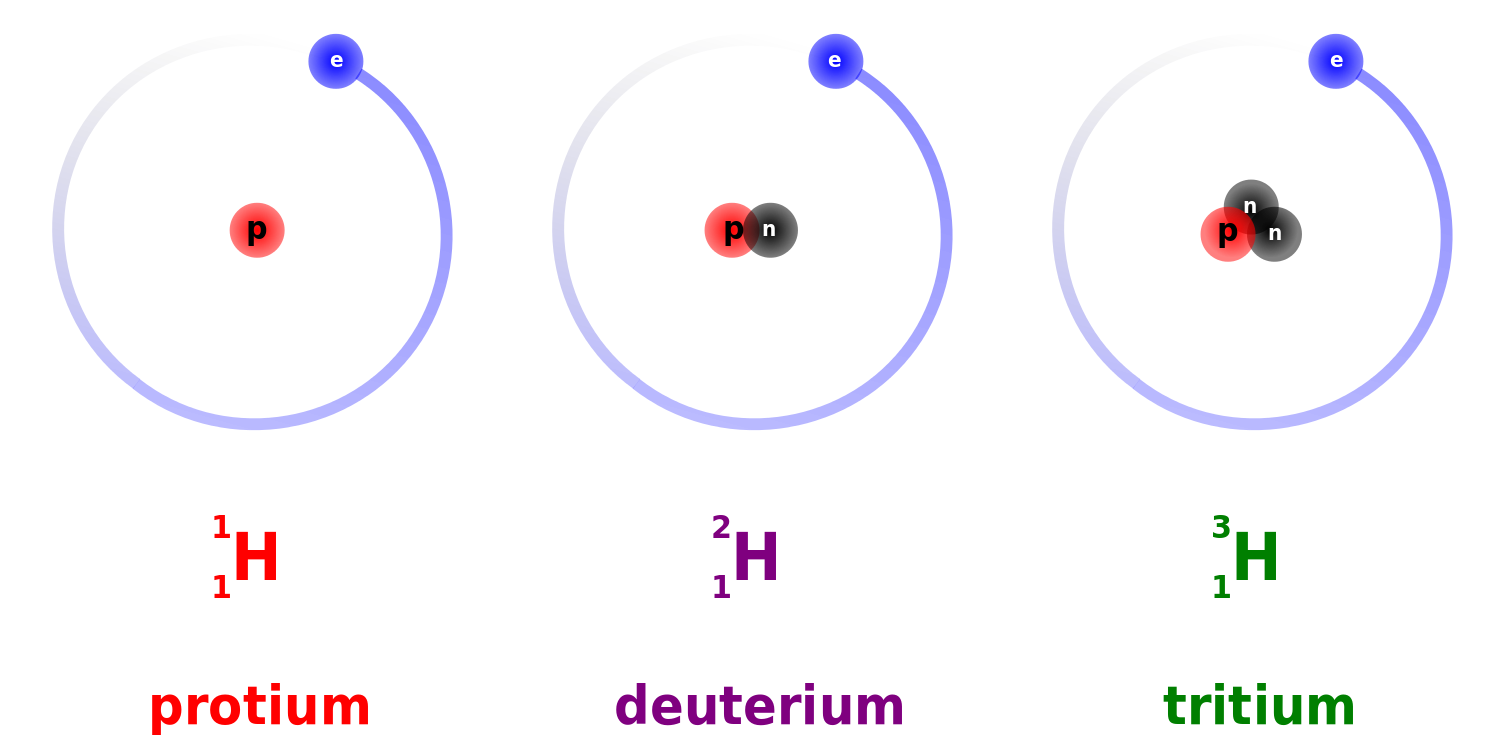
Volgens deze notatie heeft een tritiumatoom 3 deeltjes in de kern en 1 proton. Uit deze informatie is het aantal neutronen en electronen eenvoudig af te leiden. Door het atoomnummer van het massagetal af te trekken krijg je het aantal neutronen, bij tritium is dat dus 3 – 1 = 2 neutronen.
Alle elementen hebben verschillende isotopen, er bestaan meerdere varianten van het atoom met verschillende aantallen neutronen. Deze verschillen beïnvloeden de stabiliteit van het atoom. Zo zijn koolstof en kalium normaliter niet radioactief maar hun isotopen kalium-40 en koolstof-14 wel, door hun afwijkende aantallen neutronen. Isotopen zijn niet altijd onstabiel, zo zijn alle isopen van zuurstof zoals zuurstof-18, 17 en 16 stabiel.
Zoals je al hebt gezien worden isotopen aangeduid met de elementnaam en het massagetal aangezien het atoomnummer al is af te leiden uit de naam van het element. Soms krijgen isotopen ook een aparte, eigen naam zoals tritium, 3H, een waterstof atoom met 2 neutronen in plaats van nul en deuterium 2H met 1 neutron in plaats van de gebruikelijke nul.
In de rest van de website worden isotopen afgekort aangeduid, dus alleen met massagetal en elementnaam.